海蜇养殖对池塘水体中溶解氧和营养盐的影响研究
 对照区(非养殖区)和实验区(海蜇养殖区),并在5月的中旬、7月中旬以及9月中旬(即海蜇放养前期、海蜇养殖期间(6月初至8月下旬)以及海蜇采收后),分别采样水样后测定溶解氧DO、氨氮NH4+-N、硝氮NO3--N以及叶绿素Chl a含量的变化情况,探讨海蜇养殖对池塘水体中溶解氧和营养盐的影响。结果表明,池塘实验点表层和中层DO在不同月份间均存在显著性差异P<0.05),7月份DO显著低于其他月份,这与水温升高、浮游生物耗氧及有机质分解加速有关。由于海蜇的扰动作用,7月份实验点底层DO显著高于对照点的P<0.05),而实验点表层和中层略低于对照点的P>0.05)。池塘实验点和对照点NH4+-N、Chl a含量在不同月份和不同水层间均存在显著性差异P<0.05)。由于海蜇对浮游生物的捕食作用,水体中藻类含量升高,因此7月份实验点表层和中层水体中Chl a含量显著高于对照点的P<0.05)。7月份和9月份池塘中NH4+-N显著高于5月份的,并且7月份实验点的NH4+-N显著高于对照点的P<0.05),均与海蜇扰动作用相关。夏秋季节水温上升,浮游植物大量繁殖生长,消耗大量的NO3--N,因而7月份和9月份NO3--N显著低于5月份的P<0.05),并且7月份实验点中层NO3--N显著低于对照点的P<0.05)。
对照区(非养殖区)和实验区(海蜇养殖区),并在5月的中旬、7月中旬以及9月中旬(即海蜇放养前期、海蜇养殖期间(6月初至8月下旬)以及海蜇采收后),分别采样水样后测定溶解氧DO、氨氮NH4+-N、硝氮NO3--N以及叶绿素Chl a含量的变化情况,探讨海蜇养殖对池塘水体中溶解氧和营养盐的影响。结果表明,池塘实验点表层和中层DO在不同月份间均存在显著性差异P<0.05),7月份DO显著低于其他月份,这与水温升高、浮游生物耗氧及有机质分解加速有关。由于海蜇的扰动作用,7月份实验点底层DO显著高于对照点的P<0.05),而实验点表层和中层略低于对照点的P>0.05)。池塘实验点和对照点NH4+-N、Chl a含量在不同月份和不同水层间均存在显著性差异P<0.05)。由于海蜇对浮游生物的捕食作用,水体中藻类含量升高,因此7月份实验点表层和中层水体中Chl a含量显著高于对照点的P<0.05)。7月份和9月份池塘中NH4+-N显著高于5月份的,并且7月份实验点的NH4+-N显著高于对照点的P<0.05),均与海蜇扰动作用相关。夏秋季节水温上升,浮游植物大量繁殖生长,消耗大量的NO3--N,因而7月份和9月份NO3--N显著低于5月份的P<0.05),并且7月份实验点中层NO3--N显著低于对照点的P<0.05)。
关键词:海蜇;溶解氧;氨氮;硝氮;叶绿素a
海蜇Rhopilema esculenta Kishinouye)隶属于腔肠动物门(Coelentera)、钵水母纲(Scyphozoa)、根口水母目(Rhizostomeae)、根口水母科(Rhizostomatidae),其不仅有丰富的营养,同时也具有良好的药食效果[1]。海蜇处于食物链的底层,对外界环境的适应能力较强,同时水中具有非常丰富的海蜇的饵料生物,因此海蜇是人工增殖养殖及放流的优良品种[2]。近年来,随着海洋环境污染、过度捕捞以及海蜇渔场条件被破坏等原因[2],使得海区幼蛰受到严重损害[3],海蜇的自然资源量严重下滑[4]。
海蜇因其具有生长速度快、经济效益高、养殖风险低等特点,已逐渐成为水产养殖业关注的热点。相关研究表明,高密度的养殖活动会造成养殖水体的富营养化,导致养殖水环境恶化,病害频发,进而影响海域生态环境[5-6]。目前,有关海蜇规模化养殖对水域生态环境的影响鲜有报道。本文拟通过研究海蜇养殖对池塘水体中溶解氧和营养盐的影响,以期为海蜇养殖业的健康可持续发展提供参考和依据。
1 材料与方法
1.1 实验地点与材料
本实验在河北省唐山市唐山海都水产食品有限公司水产养殖基地相邻的两个大面积池塘内进行。分别在两池塘内各设置一个固定采样点作为实验点和对照点。海蜇养殖前期,对养殖池塘进行铺膜作业,并在养殖池塘周边水域扎建小孔径聚乙烯材料的围网。养殖池塘面积140 hm2、平均水深2.5 m。实验海蜇初始放养规格为伞径1.2~1.5 cm,放养密度为0.5 ind·m-2。
1.2 样品采集与处理
2015年5月中旬、7月中旬和9月中旬,即放养海蜇前期、海蜇养殖期间(6月初至8月下旬)以及海蜇采收后各采集水样一次。每次采集样品的时间是上午九点到上午十点,在每一个采样点都设有一固定浮球用来作为定点标记。每次对养殖区域的表层、中层(距表层1 m)以及底层水样分别用2.5 L有机玻璃采水器进行采集,虹吸法收集水样并固定溶解氧待测,剩余水样用0.45 μm Whatman GF/F滤膜真空抽滤后冷冻保存,每个处理3个重复。7月中旬分别对不同水层的溶解氧进行昼夜观测。
1.3 样品的测定与实验方法
溶解氧(DO)的测定采用碘量法,采用靛酚蓝法进行氨态氮(NH4+-N)的测定,利用镉柱还原法对硝态氮(NO3--N)进行测定;应用丙酮法用90%丙酮萃取滤膜16 h,在665 nm和750 nm波长下测定叶绿素a(Chl a)含量[7]。
1.4 数据统计分析
采用 SPSS 19.0软件对实验数据进行单因素方差分析(ANOVA),并采用Tukey’s多重比较分析,实验点和对照点采用独立样本t检验,确定其组间差异显著性P<0.05)。统计数据以平均值±标准差(±SD)的形式表示。
2 结果分析
2.1 海蜇养殖对池塘水体中溶解氧的影响
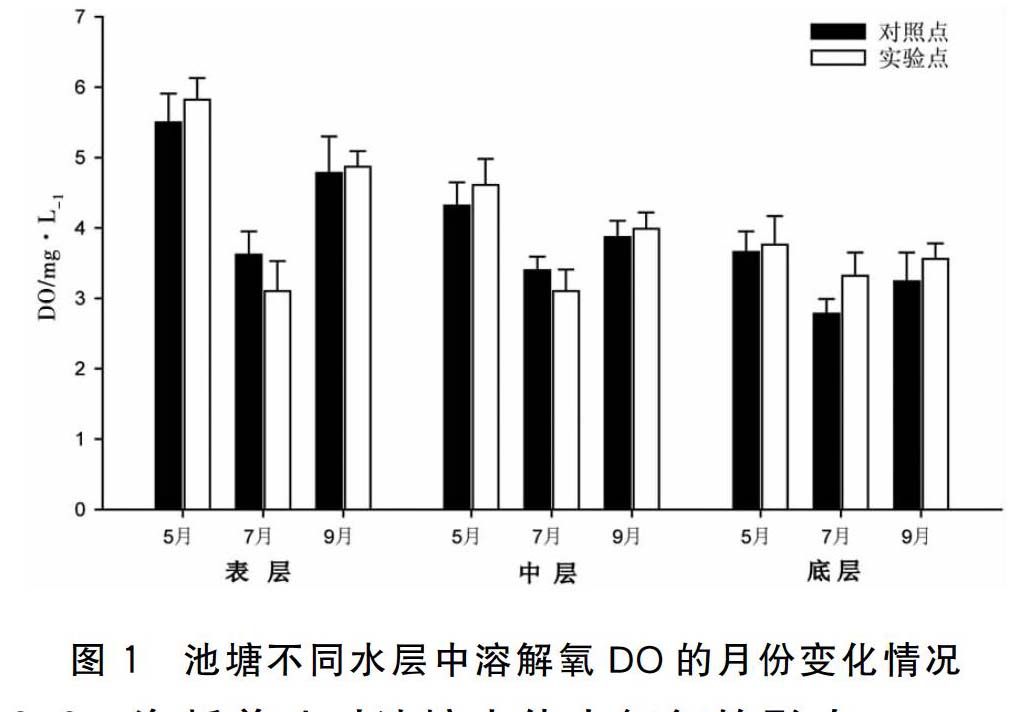
实验期间池塘不同水层中溶解氧DO的月份变化见图1,结果显示:
在池塘实验点区域内,表层和中层DO在不同月份之间都存在显著性差异P<0.05),但底层DO在各月份之间表现为差异不显著P>0.05)。其中,7月份养殖区水体的表层和中层DO均显著低于5月份及9月份。池塘对照点各水层不同月份DO差异显著P<0.05)。其中,7月份对照点表层DO显著低于5月份,7月份对照点中层DO显著低于5月份和9月份,但5月份和9月份DO却无显著性差异,7月份对照点底层DO显著高于5月份。
比较不同水层间5月和9月份DO,结果显示差异均为显著P<0.05),而在不同水层间7月份DO则表现为无显著性差异P>0.05)。其中,5月份实验点表层水体中DO显著高于底层的,中层DO与其他水层相比较并无显著性差异,在9月份,其中实验点中层以及底层的DO均显著低于表层的。5月份对照点中层和底层DO也显著低于表层的,9月份对照点表层DO显著高于其他水层。
除7月份实验点底层DO显著高于对照点的P<0.05),其他月份、水层DO在实验点和对照点间均无显著性差异P>0.05)。
2.2 海蜇养殖对池塘水体中氨氮的影响
实验期间池塘不同水层中氨氮NH4+-N的月份变化情况见图2,结果显示:
池塘实验点和对照点各水层NH4+-N在不同月份间均存在显著性差异P<0.05)。其中,7月份和9月份表层水体中NH4+-N含量要显著高于5月份。比较7月和9月,在实验点的中层和底层水样,结果表现为NH4+-N差异不显著,但在相同时间下比较表层和中层的水体中NH4+-N差异,则变现为差异不显著。
实验期间实验点和对照点各月份不同水层间NH4+-N差异显著P<0.05)。就水体中NH4+-N差异而言,表层水体显著高于中层和底层含量,而中层以及底层水体中NH4+-N表现为差异不显著P>0.05)。
5月份和9月份实验点表层、中层和底层NH4+-N和对照点相应各层间均无显著性差异P>0.05),而7月份实验点各水层NH4+-N均显著高于对照点的P<0.05)。
2.3 海蜇养殖对池塘水体中硝氮的影响
实验期间池塘不同水层中硝氮NO3--N的月份变化情况见图3,结果显示:
池塘各水层NO3--N在不同月份间均有显著性差异P<0.05)。其中,实验点和对照点7月份三个水层的NO3--N均显著低于5月份和9月份的。
实验点和对照点各月份三个水层NO3--N差异均显著P<0.05)。除7月份表层和中层NO3--N无显著性差异外,其他月份NO3--N按表层、中层和底层顺序均显著升高。
5月份和9月份实验点各水层与对照点相应水层NO3--N差异均不显著P>0.05)。7月份实验点中层NO3--N显著低于对照点的,而实验点底层NO3--N则显著高于对照点的。
2.4 海蜇养殖对池塘水体中叶绿素a的影响
实验期间池塘不同水层中Chl a含量的月份变化情况见图4,结果显示:
池塘实验点和对照点各水层水体中Chl a含量在不同月份间均存在显著性差异P<0.05)。实验点表层9月份Chl a含量显著高于5月份和7月份的,中层7月份Chl a含量最高,而底层7月份Chl a含量显著低于其他两个月份的。对照点表层7月份Chl a含量最低,中层5月份Chl a含量显著低于7月份和9月份的,底层5月份Chl a含量显著低于9月份的,7月份与5月和9月无显著差异。
实验期间各月份Chl a含量在不同水层间也均存在显著性差异P<0.05)。实验点和对照点5月份表层水体中Chl a含量均显著高于5月份中层和底层的。7月份中层Chl a含量显著高于表层和底层的,7月份实验点和对照点的底层Chl a含量均最低。9月份底层Chl a含量显著低于表层和中层的。
7月份实验点表层和中层Chl a含量显著高于对照点相应水层的,而实验点底层Chl a含量显著低于对照点的P<0.05)。其他月份和水层实验点、对照点间Chl a含量均无显著性差异P>0.05)。
3 讨论
3.1 海蜇养殖对池塘水体中溶解氧的影响
溶解氧在池塘养殖的管理中是检验水质的一项重要指标。溶解氧的含量水平能够反映水体的物理化学性质和生物活动等影响,是池塘生产性能的一项重要检验标准[7]。通过增加池塘中水体溶解氧的含量,可以有效的抑制并降低水生动物受水体中的硫化氢、氨氮等的毒害[8-9]。通过研究高密度池塘养殖溶解氧的变化过程,了解并掌握其规律变化,对改善池塘的生态系统结构、增加养殖产量、降低病害等有着重要的意义。
水体中的溶解氧含量,其主要的来源途径是光合作用,7月是海蜇养殖的一个高峰时期,海蜇通过对水中的浮游动物的大量捕食,导致植食性浮游生物数量减少,从而减低了藻类被摄取的压力[10]。这使得浮游植物数量得到飞速增长,使得光合作用得到加强,产生了更多的DO。在实验过程中发现:实验点表层以及中层DO都要普遍略低于对照点,这是由于大量浮游生物和海蜇的生物耗氧,再加上养殖过程中粪便、残饵的分解耗氧导致的[11-12]。在昼夜交替过程中,海蜇存在垂直迁移的现象(即白天在水体底层,夜间浮到水体表层),通过海蜇的垂直迁移运动,使得上下水层间水体交换得到大大加强,导致上层较多的DO被带动到池塘底层,因此在底层溶解氧,实验点含量要高于对照点含量。
在夏季和秋季,浮游植物产生较强的光合作用,但是较高的水温会导致溶解氧含量降低,再加上在温度较高时,水生生物的新陈代谢、呼吸及有机质的分解速度都明显增强。因此,水体中DO, 7月份显著低于5月份的[13-14]。
3.2 海蜇养殖对池塘水体中营养盐的影响
在本实验中5月份(即海蜇放养前)实验点和对照点营养盐指标显示差异不显著。海蜇以各类甲壳动物为主要的的生物饵料。7月份,是每年海蜇增养殖的一个高峰期,大量的海蜇通过捕食浮游动物,致使一些以浮游植物为食的浮游动物生物量降低,从而导致浮游植物得到一个空前繁殖时期,因此在本实验中,实验点7月表层和中层叶绿素a显著高于对照点的[15]。
在浅真光层中(水体75 m以内),NH4+-N是无机氮的主要存在形态,随着水深增加其含量逐渐减小[16]。7月份由于水温较高,水生生物的新陈代谢、呼吸及有机质的分解速度都明显增强使得水体中NH4+-N增多[17-20]。此外,由于水中DO较低,从而导致硝化作用减弱,这使得实验点各水层NH4+-N均显著高于对照点。
在5月份的实验区和对照区中,比较各水层Chl a的含量,变现为差异不显著。由于表层水温升高,使得表层水体的营养盐比较丰富,浮游植物具有较强的生产力,因此在5月份,本实验表层水样叶绿素a的含量要显著高于中底层。7月份,大量浮游动物被海蜇捕食,从而导致浮游植物增多,因此,本实验Chl a总含量就明显偏高[21-22]。七月份由于光照过强,使光合作用受到抑制[23-24],导致表层Chla含量要低于中层。到了9月,光照强度会渐渐减弱,浮游植物得以继续增长,使得Chl a含量表层显著高于中层和底层。由于在上层水体中存在大量的浮游植物及颗粒物,致使底层浮游植物的光合作用受到抑制,因此试验点底层Chl a含量要略低于对照点。上述结论与潘友联等人对胶州湾叶绿素a浓度的研究[25-26]及宋书群等对长江口及其邻近水域[27]结果相似。
由于夏、秋两季水温普遍升高,使得浮游植物得以大量生长繁殖,从而使光合作用增强,大量的NO3--N得以消耗,水体中NO3--N大大减少,所以比较实验点和对照点NO3--N,可以发现在7月和9月NO3--N要显著低于5月份含量,这也与贾后磊等人[28]在哑铃湾的实验研究结果一致。由于浮游植物大多分布在水体的中层及上层,对表、中层的NO3--N被吸收,因此表、中层NO3--N要显著低于底层。
每年7月,由于大量海蜇的摄食,水体中以浮游植物为食的浮游动物减少,导致浮游植物增多,对NO3--N的吸收增多,因此对照点中层NO3--N显著高于实验点。而在底层,由于海蜇的扰水作用,将溶解氧从表层带到底部,促进底部硝化作用加速进行,使得NO3--N相对于对照点有所提高,所以实验点底层NO3--N显著高于对照点。
参考文献:
[1] 孙振兴, 张明青. 海蜇的人工繁育与养殖技术[J]. 安徽农业科学, 2006, 34(3): 493-494
[2] 王永顺, 黄鸣夏, 陈正国. 张网作业对杭州湾海蜇幼体的损害[J]. 水产科技情报, 1985(1): 6-7
[3] 刘海映. 辽宁黄海沿岸海蜇资源衰败原因的初步探讨[J]. 水产科学, 1992, 11(10): 26-29
[4] 关松, 张鹏刚, 刘春洋, 王永江, 董婧, 毕远溥. 我省海蜇池塘养殖现状与存在的问题[J]. 水产科学, 2004, 23(8): 30-31
[5] 舒廷飞, 罗琳, 温琰茂. 海水养殖对近岸生态环境的影响[J]. 海洋环境科学, 2002, 21(2): 12-15
[6] 胡文佳, 杨圣云, 朱小明. 海水养殖对海域生态系统的影响及其生物修复[J]. 厦门大学学报, 2007, 46(1): 197-202
[7] 徐宁, 李德尚. 养殖池塘溶解氧平衡与日最低值预报的研究概况[J]. 中国水产科学, 1998, 5(1): 84-88
[8] 姚宏禄. 综合养鱼高产池塘的溶氧变化周期[J]. 水生生物学报, 1988, 12(3): 199-211
[9] 贾先斌. 预测鱼塘拂晓浓度的新模式[J]. 农业工程学报, 1994, 10(4): 119-124
[10] 吴颖, 李慧玉, 李圣法, 程家骅. 大型水母的研究现状及展望[J]. 海洋渔业, 2008, 30(1): 80-87
[11] Graham W M, Pages F, Hamner W M. A physical context for gelatinous zooplankton aggregations: a review[J]. Hydrobiologia, 2001, 451: 199-212
[12] 董景岗, 王海霞, 李伟. 天津近岸海水溶解氧分布特征[J]. 天津科技大学学报, 2009, 24(3): 26-30
[13] 郭秀云, 王胜, 吴必文, 石磊. 环境温度对水产养殖定量化影响的研究[J]. 安徽农业科学, 2007, 35(24): 7498-7499
[14] 崔峰. 池塘水中溶解氧变化规律的分析[J]. 安徽农业技术师范学院学报, 1999, 13(3): 73-75
[15] 郭水伙. 南海水体三项无机氮含量的垂直变化特征及其他环境要素的相关性[J]. 台湾海峡, 2009, 28(1): 71-79
[16] 唐世林, 陈楚群, 詹海刚等. 南海真光层深度的遥感反演[J]. 热带海洋学报, 2007, 26(1): 9-15
[17] 杨嘉东. 南海中部海域铵浓度及其与浮游植物的关系[J]. 台湾海峡, 1993, 12(4): 369-375
[18] Haake B, Ittekkot V, Honjo S. Amino acid hexosamine, and carbohydrate fluxes to the deep Subarctic Pacific (station P) [J].Deep Sea Research, 1993, 40: 547-560
[19] Broonk D A, Glibert P M, Ward B B. Nitrogen up take, dissolved organic nitrogen release, and new production [J]. Science, 1994, 265: 1843-1846
[20] Flindt M R, Pardal M A, Lillebo A I, et al. Nutrient cycling and plant dynamics in estuaries:A brief review [J]. Acta Oecologica, 1999, 20: 237-248
[21] Wada E, Hattori A. Nitrogen in the Sea: Forms, Abundances, and Rate Processes [M]. Raton Boston: CRC Press, Boca, 1991
[22] Gilbert P M. The interdependence of uptake and release of NH+ and organic nitrogen [J].Mar Microb Food Webs, 1993, 7(1): 53-67
[23] 陈应华, 杨宇峰, 焦念志. 海水养殖对浮游生物群落和水环境的影响[J]. 海洋科学, 2001, 25(10): 20-22
[24] 张运林, 秦伯强, 陈伟民. 湖泊光学研究动态及其应用[J]. 水科学进展, 2003, 14(5): 653-659
[25] 潘友联. 叶绿素与海洋初级生产力[J]. 海洋科学, 1987, 1: 63-65
[26] 潘友联, 郭玉洁, 曾呈奎. 胶州湾口内海水中叶绿素浓度的周年变化和垂直分布[J]. 海洋与湖沼, 1995, 26(1): 22-27
[27] 韦献革, 温琰茂, 王文强, 贾后磊, 徐昕荣. 哑铃湾网箱养殖区底层营养盐的分布于评价[J]. 中山大学学报, 2005, 44(4): 115-119
[28] 贾后磊, 温琰茂. 哑铃湾网箱养殖水体中N的含量特征[J]. 海洋环境科学, 2004, 23(2): 8-11
(收稿日期:2016-09-12)
