美洲大蠊、斑蝥提取物对3株人肿瘤细胞增殖抑制作用的研究
 对照品溶液的配制样品溶液配制:称取一定量活性样品冻干粉或浸膏,用少量DMSO溶解配制成100mg/mL的储备液,于4℃冰箱保存。实验时用DMEM或RPMI-1640培养液将浓度分别稀释为300、100、50、30、10、3μg/mL。阳性对照品溶液配制:称取一定量DDP冻干粉,配制成10mg/mL的储备液,于4℃冰箱保存。实验时用DMEM或RPMI-1640培养液将浓度分别稀释为5、05、005μg/mL。
对照品溶液的配制样品溶液配制:称取一定量活性样品冻干粉或浸膏,用少量DMSO溶解配制成100mg/mL的储备液,于4℃冰箱保存。实验时用DMEM或RPMI-1640培养液将浓度分别稀释为300、100、50、30、10、3μg/mL。阳性对照品溶液配制:称取一定量DDP冻干粉,配制成10mg/mL的储备液,于4℃冰箱保存。实验时用DMEM或RPMI-1640培养液将浓度分别稀释为5、05、005μg/mL。
23细胞培养HepG2细胞株在含有10%胎牛血清及100U/mL青霉素、100U/mL链霉素的DMEM培养基中,于37℃、5%CO2培养箱中培养。细胞形态为上皮样,贴壁生长,约每2~3日传代1次。MGC-803、Eca-109细胞株均在含有10%胎牛血清及100U/mL青霉素、100U/mL链霉素的RPMI-1640培养基中,于37℃、5%CO2培养箱中培养。细胞形态为上皮样,贴壁生长,约每2~4天传代1次。
24细胞毒性测试实验取对数生长期的HepG2、MGC-803、Eca-109细胞,制成细胞密度为1×105/mL的悬液,接种于96孔板,每孔100μL,于37℃、5%CO2 的培养箱中培养24h。细胞贴壁后,弃原培养基,每个实验孔分别加入受试样品溶液100μL,每个浓度设置3个复孔,同时设置阳性对照(DDP)、阴性对照(等量不含药物的培养液)和空白对照(只有等量培养基、没有细胞),以上于37℃、5%CO2培养箱中分别继续培养24h、48h、72h后,弃去上清液,每孔加入20μL,5mg/mL的MTT溶液,37℃、5%CO2培养箱中孵育4h,然后每孔加入150μL的DMSO,于微量振荡器上振荡至甲臜完全溶解,在酶标仪上于570nm波长处测定各孔的OD值。
25统计学处理按以下公式计算药物对肿瘤细胞增殖的抑制率(%):细胞增殖抑制率(%)=(OD阴性— OD样品)/(OD阴性 — OD空白)×100%;以药物浓度的对数值为横坐标,细胞增殖抑制率为纵坐标绘制量效曲线,并分别用SPSS170的Logistic回归模型计算不同作用时间后的半数抑制浓度(IC50)。
3结果
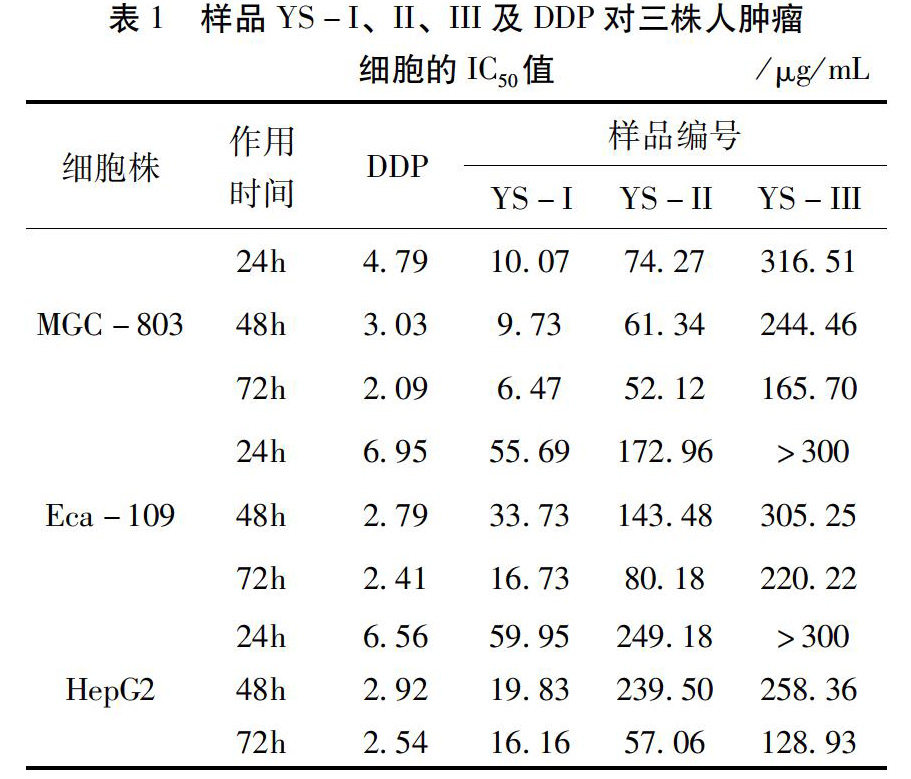
31样品对所选肿瘤细胞的增殖影响效果3个活性样品YS-I、YS-II、YS-III及阳性药DDP对人胃癌细胞株MGC-803、人食管癌细胞株Eca-109、人肝癌细胞株HepG2的IC50值,详见表1。
32样品对所选细胞增殖抑制作用的时效、量效关系分析3个活性样品YS-I、YS-II、YS-III及阳性药DDP对人胃癌细胞株MGC-803、人食管癌细胞株Eca-109、人肝癌细胞株HepG2增殖抑制作用的时效、量效关系分析结果见图1、2、3。
实验结果提示3个昆虫类活性样品YS-I、YS-II、YS-III对人胃癌细胞株MGC-803、人食管癌细胞株Eca-109、人肝癌细胞株HepG2的增殖均具有一定的抑制作用;通过量效和时效关系分析表明,3个样品对所选三株细胞的增殖抑制存在一定的剂量和时间依赖关系。其中YS-I对MGC-803细胞株在处理24h、48h、72h的IC50值分别为1007、973、647μg/mL,已接近阳性药DDP IC50值的1/2至1/3,具有较强的肿瘤细胞增殖抑制作用;对另两株细胞株Eca-109和HepG2,作用72小时后的IC50值也小于20μg/mL,提示YS-I对三株人肿瘤细胞、尤其是胃癌细胞的增殖具有明显抑制作用。
4讨论
蒋永新等[17]研究表明“康复新液”(主要成分为美洲大蠊提取物)有抑制MGC-823肿瘤细胞生长、阻滞细胞周期和诱导细胞凋亡等作用,梁刚等[18]研究表明美洲大蠊提取物有抑制人肝癌细胞Bel- 7402裸鼠移植瘤生长、下调血管内皮生长因子(VEGF)的作用。YS-I是美洲大蠊聚酰胺有效部位,对人胃癌细胞株MGC-803、人肝癌细胞株HepG2的增殖均具有较好抑制作用,而人胃癌细胞株MGC-803、人肝癌细胞株HepG2分别与MGC-823、Bel- 7402细胞株为同源细胞,推测YS-I抑制肿瘤细胞增殖的机制可能与阻滞细胞周期、诱导细胞凋亡、下调血管内皮生长因子(VEGF)相关。YS-I尚为多成分混合物,故从其中纯化出具有研究和开发前景的高效抗肿瘤成分值得引起重视。YS-II、YS-III均为斑蝥的有机溶剂提取部位,在配制样品溶液时,会有少量样品析出,这可能会对斑蝥素抑制肿瘤细胞的效果有一定影响。本研究显示,昆虫来源提取物对人肿瘤细胞确实存在明显的抑制(或杀灭)作用,具有对其进行深入研究的科研及临床应用价值。
参考文献
[1]Stewart BW, Wild CP. World Cancer Report 2014[M]. IARC Nonserial Publication,Geneva, Switzerland, 2015.
[2]Wanqing Chen,PhD MD,Zheng R,Baade P D,et al. Cancer statistics in China,2015[J]. Ca A Cancer Journal for Clinicians, 2016,66(2):115-132.
[3]张晶,李晓芳,刘昱,等.肿瘤流行病学现状及抗肿瘤中药的研究进展[J].山东化工,2015,44(12):42-44.
[4]李琦,范忠泽,李先茜,等. 去甲斑蝥素微球介入治疗大鼠肝癌疗效及其机制研究[J]. 中西医结合学报,2006,4(4):378-383.
[5]施贵荣,庄孝龙,郭美仙,等. 喙尾琵琶甲提取物的体外抗肿瘤活性研究[J]. 安徽农业科学,2012(6):3387-3388.
[6]牛宗新,李兴暖,何巍,等. 土鳖虫水提物联合环磷酰胺抗肿瘤增效减毒作用研究[J]. 中华中医药学刊,2012(6):1264-1265.
[7]刘亚楠. 中药斑蝥研究进展[J]. 中药与临床,2013,4(1):50-52.
[8]娄田田,杜娟,陈祥盛,等. 斑蝥素及衍生物抗肿瘤机制的研究进展[J]. 亚太传统医药,2012,8(10):205-207.
[9]王晓华,马萍,尹元琴,等. 斑蝥素对A549细胞增殖抑制作用的研究[J]. 沈阳药科大学学报,2006,23(9):598-601.
[10]何正春,彭芳,宋丽艳,等. 美洲大蠊化学成分及药理作用研究进展[J]. 中国中药杂志,2007,32(21):2326-2331.
[11]罗廷顺,高孟婷,马芳芳,等. 美洲大蠊药理作用及临床应用研究进展[J]. 安徽农业科学,2012,40(4):888-892.
[12]蔣永新,王熙才,金从国,等. 美洲大蠊提取物对Lewis肺癌小鼠抑瘤作用的研究[J]. 昆明医科大学学报,2007,28(5):13-16.
[13]何正春,王晓雨,胡明辉,等. 美洲大蠊提取物对3株人体呼吸系统肿瘤细胞的细胞毒性研究[J]. 中国现代药物应用,2009,3(7):1-2.
[14]何正春,王晓雨,杨雷香,等. 美洲大蠊提取物对3株人体生殖系统肿瘤细胞的细胞毒性研究[J]. 西北药学杂志, 2009,24(4):271-272.
[15]何正春,王晓雨,杨雷香,等. 美洲大蠊提取物对3株消化系统肿瘤细胞的细胞毒性研究[J]. 中国药业,2009,18(9):11-12.
[16]刘光明,赵昱,何正春,等. 一种用聚酰胺富集美洲大蠊抗肿瘤有效部位的制备方法[P]. 中国专利:CN200710067706.X 2007-08-22.
[17]蒋永新,王熙才,金从国,等. 康复新体外诱导胃癌BGC-823细胞凋亡的实验研究[J]. 昆明医科大学学报,2006,27(2):5-9.
[18]梁刚,张丹,张红,等. 美洲大蠊多肽对人肝癌细胞Bel-7402裸鼠移植瘤生长的抑制作用[J]. 中国新药杂志,2016(6):687-691.
(收稿日期:2017-03-22编辑:陶希睿)
上一篇:非接触式扭矩传感器电路原理
下一篇:《东方红》是如何上天的?
