虎杖苷转化菌的筛选及所产酶的性质研究
 对照品的纯度为98%,购自西安华翠生物技术有限公司。甲醇(HPLC级)、乙醇、乙睛(HPLC级)、乙酸乙酯。
对照品的纯度为98%,购自西安华翠生物技术有限公司。甲醇(HPLC级)、乙醇、乙睛(HPLC级)、乙酸乙酯。
仪器:GNP-9080隔水式恒温培养箱(上海精宏实验设备公司);ES-315高压蒸汽灭菌锅(TOMY,Japan);Agilent 1260高效液相色谱仪(Agilent公司);HD-930型组合式全温摇床(江苏太仓市博莱特实验仪器厂);高速离心机Sigma 3k30(Sigma公司)。
1.2 菌种筛选与鉴定
1.2.1 虎杖苷转化菌的筛选 初筛:取虎杖粉末用无菌水冲洗,梯度稀释,按常规方法涂布,30 ℃培养2 d,挑选出长势良好的单菌落,保藏待用。复筛:将初筛菌种活化培养,制成孢子悬液,转接至复筛培养基,30 ℃、160 rpm培养,取样检测。
1.2.2 菌种鉴定 将筛选到的菌株接种到PDA培养基上,在不同时间观察菌落生长性状,待产孢后取菌丝制作临时玻片在透视显微镜下观察菌丝、分生孢子梗、分生孢子,并描述它们的形态特征;用透视显微镜观察菌丝的自然生长和分支状况。根据形态特征对菌株进行分类鉴定。
1.3 酶学性质研究
1.3.1 粗酶液的制备 将活化后的菌种斜面用无菌水制成孢子悬浮液,接种到发酵产酶培养基,28 ℃条件下静止培养48 h。取固体曲,用pH值为5.0的磷酸氢二钠-柠檬酸缓冲液浸提,固液比为1 ∶ 10,将其用尼龙纱布过滤,4 500 rpm离心15 min,上清液即为酶液。
1.3.2 β-葡萄糖苷酶最适温度及稳定性 在不同温度下分别以1%水杨苷和0.05%虎杖苷为底物,按常规法测定酶活力,分别于50、55、60、65、70 ℃测定酶活力。酶液分别在30、40、50、60、70 ℃下保温12 h,测定酶活力。取酶液,放于 60 ℃ 水浴中,分别在2、4、6、8、10、12 h取样,检测酶活力。
1.3.3 pH值对β-葡萄糖苷酶活性及酶的酸碱稳定性的影响 分别配制pH值为3.0、4.0、5.0、6.0、7.0的磷酸氢二 钠- 柠檬酸缓冲液,常规方法测定酶活力。此外,将酶液与上述不同pH值缓冲液在60 ℃下放置1 h后,按常规法测定对应的酶活力。
1.3.4 β-葡萄糖苷酶的底物特异性 分别配制浓度为 0.5% 的甜菊苷、虎杖苷、水杨苷、纤维二糖、京尼平苷溶液,再以它们为底物,按常规法测定对应的酶活力。
1.3.5 不同金属离子对β-葡萄糖苷酶活力的影响 选取氯化钠、氯化钙、硫酸镁、硫酸亚铁、硫酸钴为试剂,在酶反应液中分别加入上述金属离子,使其终浓度为1.0 mmol/L,于60 ℃温30 min,按常规法测定酶活力,以不加金属离子的酶活力为100%。
1.4 β-葡萄糖苷酶酶活力测定方法
水杨苷法测定β-葡萄糖苷酶活力:于0.2 mL水杨苷溶液中加入0.2 mL酶液,混匀后60 ℃反应10 min,加入1 mL 3,5-二硝基水杨酸(DNS)试剂后沸水浴5 min,冷却后蒸馏水定容至10 mL,在540 nm下测定其吸光度。
酶活力单位定义:1 mL酶液在pH值5.0、60 ℃下催化反应1 min,产生1 μg葡萄糖所需的酶量为1个酶活力单位。
2 结果与分析
2.1 虎杖苷转化菌的篩选
通过初筛得到11株长势较好的菌种,菌株编号及转化27 h虎杖苷转化率如图1所示。初筛获得的11株菌种中,仅有H4、H6和2-6号菌有转化效果,且在转化27 h后转化率都达到了最大。其中H6号菌的转化率最高,为98%,故选取H6号菌作为虎杖苷转化菌株。
2.2 转化菌的鉴定
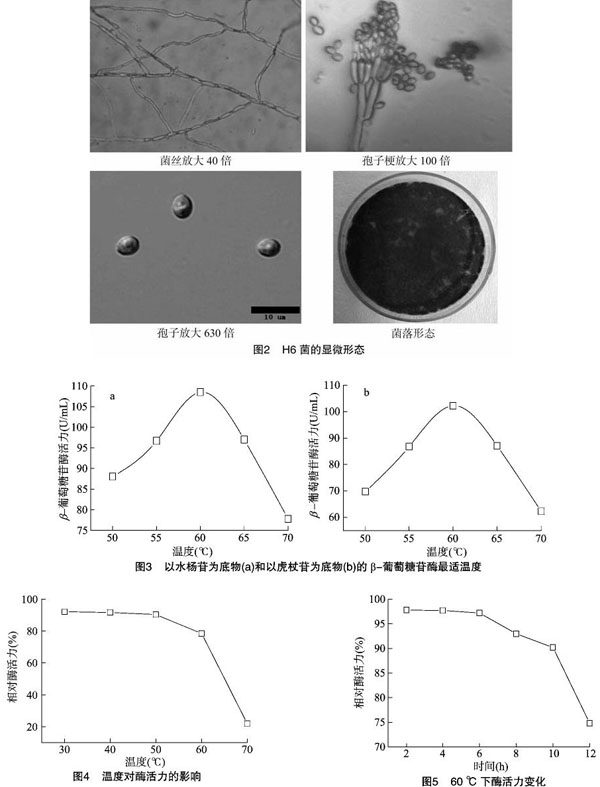
通过观察,菌落为绿色,背面为黄色。显微镜下观察并记录菌种的显微形态。由图2可知,显微镜下菌丝无色透明,表面光滑,有隔膜,直径为4~5 μm,菌丝上产生简单的长而直立的分生孢子梗,分生孢子梗分枝呈扫帚状。孢子梗上着生分生孢子链,分生孢子为椭圆形,两端稍细,长5~7 μm,宽 3~4 μm。根据以上菌落形态、菌丝形状、孢子的形状及大小,初步确定为青霉属。
2.3 酶学性质研究
2.3.1 β-葡萄糖苷酶最适温度 由图3-a和图3-b可知,随着反应温度的增加,酶活力先提高后降低,在60 ℃时酶活力最高。以水杨苷为底物和以虎杖苷为底物测得的酶活力变化趋势一致。以水杨苷为底物测定酶活力能准确地反映该酶对底物的转化能力。
2.3.2 酶的稳定性影响 酶液分别在30、40、50、60、70 ℃下保温12 h,按常规法测定对应的酶活力。取酶液,放于60 ℃水浴中保藏,分别在2、4、6、8、10、12 h取样,常规方法检测酶活力。由图4可知,β-葡萄糖苷酶在50 ℃以下保温12 h后基本不失活,在60 ℃保温12 h后酶活力有损失,60 ℃以后酶活力损失较大。由图5可知,60 ℃下,1~10 h内酶活力较稳定,10 h后酶活力降幅较大。
2.3.3 pH值对β-葡萄糖苷酶活性及酶的酸碱稳定性的影响 分别配制pH值为3.0、4.0、5.0、6.0、7.0的磷酸氢二 钠- 柠檬酸缓冲液,采用常规方法测定酶活力。此外,将酶液与上述不同pH值缓冲液在60 ℃下放置1 h后,按常规法测定其对应的酶活力。由图6可知,β-葡萄糖苷酶活力随着pH值的上升先提高后降低,在pH值为5.0时酶活力最高,这与多数文献报道的一致。由图7可知,酶在pH值为4.0~6.0之间时,相对酶活力较高,保持了较高的稳定性,在pH值>6.0或pH值<4.0时,酶活力明显下降。
2.3.4 β-葡萄糖苷酶的底物特异性 在标准条件下,用 0.5% 的不同底物与酶液反应,结果如表1所示。由表1可知,酶对虎杖苷的水解效果最好,对水杨苷的水解效果其次,对纤维二糖和京尼平苷的水解效果较差,对甜菊苷的水解效果最弱。
2.3.5 不同金属离子对β-葡萄糖苷酶活力的影响 选取氯化钠、氯化钙、硫酸镁、硫酸亚铁、硫酸钴为试剂。在酶反应液中分别加入上述金属离子, 使其终浓度为 1.0 mmol/L, 于60 ℃温30 min,按常规法测定对应的酶活力,以不加金属离子的酶活力为100%。从表2可以看出,金属阳离子对该酶都有不同程度的影响,其中Fe2+、Na+和Ca2+对酶活力有轻微的激活作用,而Mg2+和Co2+则有一定的抑制作用。
3 结论
本试验通过初筛和复筛得到1株霉菌,可将虎杖苷转化为白藜芦醇,经形态学鉴定为青霉菌属。对其所产酶的酶学性质进行了研究,结果表明:酶的最适pH值为5.0,pH值在4.0~6.0之间时,酶的稳定性较好;酶最适反应温度为 60 ℃,并且在该温度下具有较好的热稳定性;Fe2+、Na+和Ca2+对酶活力有激活作用;虎杖苷是该酶理想的水解作用底物。
本试验的结果可以拓展白藜芦醇的制备途径[17],增加虎杖的利用价值。可以用虎杖中药材为原料,先提取虎杖苷,利用该菌株所产的酶液转化虎杖苷,或将酶液制成固定化酶再将虎杖苷转化成白藜芦醇。另外,还可以将虎杖药材粉碎后与该菌进行共发酵,从发酵后的固体曲中提取白藜芦醇。
参考文献:
[1]刘盛楠,邵淑丽,隋文静,等. 白藜芦醇诱导肺癌A549细胞凋亡[J]. 基因组学与应用生物学,2015,34(4):685-691.
[2]ztürka E,Arslana A K K,Yerera M B,et al. Resveratrol and diabetes:a critical review of clinical studies[J]. Biomedicine & Pharmacotherapy,2017,95:230-234.
[3]Harper C,Pate B B. Resveratrol suppresses prostate cancer progression in transgenic mice[J]. Carcinogenesis,2007,28(9):1946-1953.
[4]董 雯,王 蓉. 白藜芦醇诱导细胞自噬在神经退行性疾病进展中的作用[J]. 药学学报,2016,51 (1):18-22.
[5]Patel K R,Brown V A,Jones D J,et al. Clinical pharmacology of resveratrol and its metabolites in colorectal cancer patients[J]. Cancer Res,2010,70(19):7392-7399.
[6]Alejandra A F,Helder D S,Robert S F,et al. Formation stability and antioxidant activity of food-grade multilayer emulsions containing resveratrol[J]. Food Hydrocolloids,2017,71:207-215.
[7]Wang W B,Lai H C,Hsueh P R,et al. Inhibition of swarming and virulence factor expression in Proteus mirabilis by resveratrol[J]. J Med Microbiol,2006,55(10):1313-1321.
[8]Tung B T,Rodriguez-Bies E,Talero E,et al. Anti-inflammatory effect of resveratrol in old mice liver[J]. Exp Gerontol,2015,64:1-7.
[9]李先寬,李赫宇,李 帅,等. 白藜芦醇研究进展[J]. 中草药,2016,47(14):2568-2578.
[10]张文根,杨赛刚,李 波,等. 中国寥科植物化学成分研究进展[J]. 现代生物医学进展,2008,8(2):393-396.
[11]周建军,张宏杰,杨培君. 不同地区虎杖中白藜芦醇苷及苷元的含量比较[J]. 中药材,2005,28(l):31-33.
[12]任建伟. β-葡萄糖苷酶高产菌株选育及发酵条件优化[D]. 杭州:浙江大学,2015.
[13]田天丽. 微生物发酵转化虎杖的研究[D]. 成都:四川大学,2007:6-7.
[14]叶秋雄,黄 苇. 白藜芦醇苷的稳定性研究[J]. 食品工业科技,2011,32(4):155-157.
[15]王 辉. 微生物转化虎杖中白藜芦醇苷及其产物的分离纯化[D]. 大连:大连理工大学,2008:29-30.
[16]陈蓉蓉,姜 华,浦含林. 酶解法制备白藜芦醇的工艺优化[J]. 食品工程,2011(11):151-154.
[17]孙诗妻,张笑笛,宋 字. 葡萄中白藜芦醇合成酶基因的克隆及其转化黄芪研究[J]. 江苏农业科学,2017,45(9):38-41.黄月华,张铭阑,章志云,等. 蚯蚓粪对扑热息痛的吸附特性[J]. 江苏农业科学,2019,47(1):268-273.
下一篇:新农村,“农”有所为
